Tänk dig att du hämtar ut ett receptbelagt läkemedel. När farmacevten bakom apoteksdisken expedierar produkten börjar det blinka rött på datorskärmen. Någonting är fel upplyser apotekspersonalen och behåller paketet. Så här är det meningen att det ska fungera när ett nytt EU-direktiv är verklighet.
Direktivet om säkra läkemedelsförpackningar kom redan 2011 och är en del i den nya europeiska lagstiftningen som kallas läkemedelspaketet eller pharma-package. Syftet är att göra det svårare för förfalskade produkter att ta sig in i de legala distributionskanalerna och om så sker, göra det enkelt att spåra var en viss förpackning finns och förhindra att konsumenten använder produkten.
För att få till stånd ett fungerande system pågår nu samarbeten med såväl original- och generikaföretag, parallellhandlare och förpackningsindustri, som landsting, myndigheter och kommuner.
– Det som är både svårt och roligt med projektet är att det involverar så många aktörer, allt från läkemedelsföretag och apotek till tryckerier och distributörer, säger Anita Finne Grahnén på branschorganisationen Lif.
Hon är en av dem som arbetat med projektet under flera år och för Lifs räkning suttit med i ett antal diskussioner och projektgrupper för att försöka hitta gemensamma lösningar på hur dessa system kan se ut. Men svårigheten är att än så länge vet ingen exakt vad den nya lagen kommer att innebära så arbetet pågår med ett rörligt mål. Först 2014 kommer det att preciseras vilka krav som ställs i så kallade delegerade akter som kommer från EU-kommissionen.
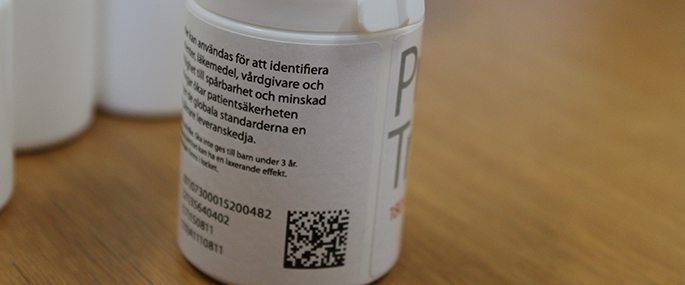
Förändringarna består i princip av två delar. Den ena är att läkemedelsförpackningarna ska vara utformade så att det märks om någon har försökt öppna dem. Detta kan lösas med till exempel en perforerad förslutning eller en tejp som det syns om någon försökt få upp. Det andra är att varje förpackning ska få en unik kod för att göra det möjligt att kontrollera att en förpackning är äkta. Denna ska sättas på vid packning och läsas av vid expediering på apotek eller inom slutenvården.
– Vi har idag ingen information vad det gäller utformningen av koden eller hur detaljerade kraven blir. Det kommer att beslutas av EU-kommissionen under 2014. Förmodligen kommer det att handla om en 2D-kod, en så kallad datamatrix, men helt säkert vet vi inte, säger Annika Wennberg, koordinator för frågan på Läkemedelsverket.
När de nya förpackningsspecifika koderna införs kan de ersätta dagens streckkoder. Men det är också möjligt att all den information som finns i streckkoden inte kommer att kunna inkorporeras och i slutändan kan det bli flera koder som får samsas på en förpackning.
För enkelhetens skull vore det såklart bra om man inom EU kunde enas om ett och samma system, men det finns flera hinder för detta. De nya reglerna kommer till exempel att gälla i princip alla receptbelagda preparat med möjlighet att göra undantag. Vissa receptfria läkemedel kan också komma att omfattas men detta beslutas av EU-kommissionen efter förslag från medlemsländerna. Ett läkemedels receptstatus bestäms nationellt och även om många produkter idag godkänns centralt i hela EU så kan det finnas olika uppfattning om vilka preparat som ska omfattas av de nya säkerhetskraven.
Runt om i Europa pågår ett antal projekt med att ta fram nya lösningar som studeras av EU-kommissionen inför att de fattar ett beslut.
– Systemet där alla unika förpackningskoder läggs in av tillverkarna kommer att behöva vara gemensamt inom hela EU. Sedan kan man ha olika system där slutanvändaren kopplar upp sig för att läsa av en förpackning, säger Annika Wennberg.
Fabriker som tillverkar för eller ligger i andra delar av världen kan också behöva jämka med krav som ställs i dessa länder. I Kalifornien har man ett liknande regelverk för förpackningar som träder i kraft 2016 och i Kina redan 2014 och detta är något som de som arbetar med frågorna nu sneglar på
– Ingen vill bygga tre olika förpackningslinjer för tre olika världsdelar. Helst vill vi ha en lösning som passar alla marknader, säger Susanne Nilsson, logistikkoordinator på Pfizer i Sverige.
På Pfizer har man förberett sig på förändringarna i flera år och har redan bytt ut förpackningarna för flera produkter. Allt för att kunna vara förberedda när de nya direktiven börjar gälla.
– Från branschen hoppas vi att kraven kommer att vara så öppna som möjligt så att de system vi redan har skapat kan vara kvar. Vi måste jobba utifrån det antagandet och tro på de idéer vi har. Det kan bli så att vi behöver ställa om vår produktion, men det får vi veta när akterna presenteras, säger hon.
I väntan på detaljerna är det vad företagen kan göra, förbereda så gott det kan och se över allt från förpackningar till distribution.
– Många läkemedel tillverkas lång tid innan de når marknaden och en sådan här omställning kräver planering, säger Anita Finne Grahnén på Lif.