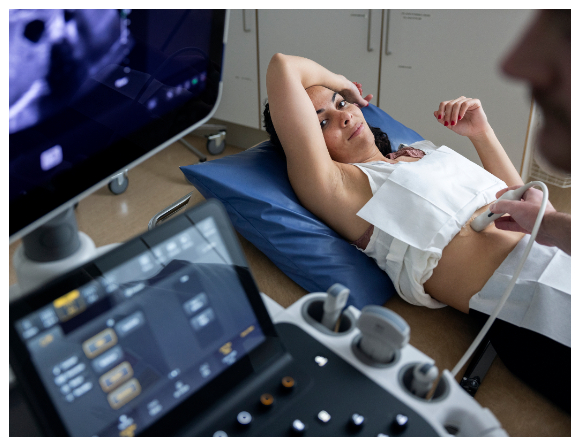
Regeringen ger Läkemedelsverket i uppdrag att underlätta implementeringen av nya EU-regler för medicintekniska produkter samt medicintekniska produkter för in vitro-diagnostik, som blodprov och vävnadsprov.
Aktörer inom området ska få den information och rådgivning som krävs för att kunna följa de nya reglerna.
Svenska synpunkter på EU-regler
Enligt uppdraget i regleringsbrevet ska Läkemedelsverket också arbeta för att öka antalet anmälda organ inom Sverige.
Myndigheten ska också arbeta för att svenska ståndpunkter ska tas tillvara i det europeiska arbetet med implementeringen av de nya förordningarna.
– Vi behöver ha en väl fungerade implementering av nya regelverk som stödjer innovation och säkerhet inom medicinteknik. Genom detta uppdrag stärker vi Sveriges position inom området och säkerställer att vi kan möta framtidens hälsoutmaningar, säger sjukvårdsminister Acko Ankarberg Johansson i ett pressmeddelande från regeringen.
”Behövs mer regulatorisk kompetens”
Läkemedelsverket ska redovisa sitt uppdrag senast den 27 februari 2026. Myndigheten får 4 miljoner för genomförandet av arbetet.
– Det är ett välkommet uppdrag som också visar på vikten av svenska aktörer behöver förstå och anpassa sina verksamheter efter de nya regelverken. Det är tydligt att det fortsatt behövs mer regulatorisk kompetens inom området, säger Lena Björk, som är tillsynsdirektör på Läkemedelsverket, i ett pressmeddelande från Läkemedelsverket.
– Innovationen går med rasande fart men för att nya och betydelsefulla produkter ska kunna komma till nytta för patienter och konsumenter måste de vara säkra och ändamålsenliga, säger Lena Björk.