Proteinläkemedel är inte särskilt patientvänliga. De måste ofta ges som injektioner, vilket kan begränsa behandlingsmöjligheterna. Flera medel bryts också ner så snabbt att det krävs täta injektioner eller pumptillförsel. Ibland behövs det även sjukvårdpersonal till hjälp, som vid en del cancerbehandlingar.
Mycket forskning pågår och nu har jakten på nya och bättre proteinläkemedel har gått in i en ny fas. Förra året publicerades en fullständig atlas över kroppens proteiner som visar var alla byggstenar hör hemma. Det delvis svenska projektet har också analyserat de proteinläkemedel som finns idag och ger fler ledtrådar till ett redan hett område.
Dagens proteinläkemedel har flera begränsningar och många medel skulle kunna användas mycket bättre med ny teknik. Dessutom kan en stor mängd proteiner bli behandlingar om man bara kan hitta rätt form för dem.
Det finns redan flera sätt att göra injektionstekniken mer patientvänlig. Läkemedel kan till exempel ges genom huden via mycket små nålar, mikronålar, som levererar aktiv substans. Tekniken används idag för influensavaccinering och för ett flertal kosmetiska behandlingar. Försök pågår även med att göra smärtfria injektioner med tekniker som bygger på anordningar som till exempel vibrerar eller ger tryck på huden samtidigt som nålen går in.
Allra lättast för patienterna är förstås läkemedel man kan svälja. Problemet är att proteinerna oftast bryts sönder i magen innan kroppen hunnit ta upp dem. Flera olika beredningar har testats för att tillverka biologiska läkemedel som kan sväljas men med varierande resultat. Oftast måste den aktiva substansen förändras för att passa den tänkta tekniken.
Att istället tillverka läkemedlet så det går att inhalera kan vara en annan praktisk lösning. Men inhalerbara medel kan absorberas väldigt snabbt vilket kan betyda att medlet fortfarande måste tas ofta. Det är inte heller lika lätt att ha kontroll över doseringen. Idag tittar man främst på terapiområden där man vill ha ett snabbt tillslag och kort effekt, som vid migränbehandling. Till exempel insulin har visat sig fungera i inhalerbar form.
Problemet med hur snabbt läkemedlet bryts ned kan delvis lösas genom att man kopplar ihop proteinet med en annan molekyl till exempel polyetylen-glykol, PEG och ger läkemedlet som injektion.
– Metoden är begränsad då det kan vara väldigt svårt att styra var PEG-molekylen hamnar. Fastnar det på fel ställe kan proteinet bli inaktivt. Det leder i förlängningen också till att man inte heller riktigt kan styra vad för molekyl det egentligen är som man ger patienten, säger Torbjörn Gräslund, som leder en forskargrupp inom proteinteknologi på Kungliga tekniska högskolan, KTH.
Torbjörn Gräslunds forskargrupp vill göra effektivare proteinläkemedel och har ett lovande projekt på gång. De har tittat på kroppens egna sätt att återanvända vissa proteiner, i det här fallet antikroppar. Det går att lura kroppen att inte bryta ned ett läkemedel, om det modifieras och får en signal om att det ska sparas. Forskarna har skapat ett sådan redskap, en liten proteintagg som kopplas till läkemedlet. Taggen gör att kroppen skyddar proteinet likt en antikropp och det bryts då inte ned lika lätt.
Metoden bygger på kunskaper om den så kallade neonatala Fc-receptorn, FcRn. Den har en livsviktig funktion hos foster då den transporterar antikroppar från mamman genom placentan och bygger upp barnets immunförsvar. Receptorn finns även i tunntarmen och gör att ammande barn får i sig antikroppar från bröstmjölken. Vad som gör receptorn så användbar är att den finns på många ställen i kroppen, även hos vuxna. Framförallt sitter den i kärlväggarna, men finns även i lungorna och tarmepitelet. Receptorn ökar förmågan att ta upp proteiner på platsen där den finns, och förlänger sedan deras halveringstid. Om man kan använda sig av FcRn på ett effektivt sätt öppnar det upp stora möjligheter till effektivare men också helt nya läkemedel. Johan Seijsing, som haft projektet om FcRn som en del av i sitt doktorandarbete vid KTH, kallar receptorn en läkemedelstillverkares heliga graal.
Förutom kunskapen om FcRn bygger metoden på hur naturliga antikroppar ser ut. I ena änden på dem sitter den så kallade Fc-delen som kan binda till olika receptorer. Binder den till den neonatala Fc-receptorn räddas antikroppen från att brytas ner och transporteras istället tillbaka till cellytan där den lossnar igen.
Sedan tidigare vet man att genom att ta Fc-delen från en antikropp och koppla ihop med ett tänkt läkemedel förlängs effekten. Det finns läkemedel på marknaden som bygger på metoden och exempel är behandlingar mot blödarsjuka där läkemedlet ges som långverkande injektioner. En nackdel med att använda hela Fc-delar är att de normalt har kvar sitt samspel med övriga immunsystemet vilket kan leda till oönskade immunologiska reaktioner. Dessutom är Fc-delen relativt stor vilket kan begränsa användandet.
Men KTH-forskarna är lösningen på spåren. Forskargruppen kombinerade kunskaperna om Fc-delar med vad man vet om den neonatala Fc-receptorn.
– Målet var att hitta en proteinmolekyl så liten som möjligt som man kontrollerat kan fästa på det protein som man vill ha som läkemedel. Den lilla proteintaggen, en så kallad affibodymolekyl ska ha kvar funktionen som en Fc-del har, den ska alltså binda till den neonatala Fc-receptorn. Samtidigt ska den inte ha några andra antikroppsfunktioner alls. Vi har helt enkelt utgått från scratch och skapat sådana affibodymolekyler. Vår teknik fungerar både generellt och är enkel, säger Torbjörn Gräslund.
När forskarna satte ihop taggarna med andra proteiner så behöll proteintaggen sin struktur och funktion, och det gjorde även proteinet som de kopplade den till. Den enda funktionen taggarna ska ha är att binda till den neonatala Fc-receptorn som räddar proteinet så det släpps ut i cirkulationen igen. För att testa om taggen fungerade i praktiken kopplades den ihop med ett protein som injicerades i möss. Den bästa affibodyn förlängde komplexets halveringstid nästan tre gånger, från 33 till 91 timmar.
– Ytterligare en fördel med affibodytekniken är att det är väldigt enkelt att producera taggen. Om proteinet man vill använda går att tillverka i bakterier gör man hela fusionen på en gång. Fc-fusioner är normalt mycket mer komplicerade att göra, berättar Torbjörn Gräslund.
Proteinläkemedel innebär också alltid en risk för att kroppen utvecklar antikroppar mot medlet, även om det är ett humant protein. KTH-forskarna har gjort ett flertal tester som alla talar emot att deras taggar skulle vara immunogena.
Forskargruppen testar även om det går att förlänga halveringstiden på de monoklonala antikroppar som används som läkemedel idag. De skyddas redan från början genom att antikropparna från början har en Fc-del i sig, men man hoppas kunna öka verkningstiden genom att fästa proteintaggen.
– Utöver monoklonala antikroppar håller vi just nu på med försök där en tagg kopplats till en läkemedelskandidat som normalt bryts ned väldigt fort. Substansen skulle behövas ges kontinuerligt med pump för att teoretisk kunna fungera som ett läkemedel. Med vår tag tror vi att halveringstiden blir tillräckligt lång för att det ska kunna fungera som medicin. Alla de proteiner som har för kort halveringstid för att kunna användas som läkemedel kan vi testa och använda med vår teknik. Vi kan definitivt förbättra cancerbehandlingar med metoden. Andra uppenbara behandlingsområden är sjukdomar som beror på rubbningar av hormoner. Dessa sjukdomar kräver ofta täta injektioner idag, säger Torbjörn Gräslund.
– Med tanke på att FcRn finns i lungorna och tarmarna borde det också vara möjligt att göra långtidsverkande läkemedel med proteintaggen som tas upp där. Men först måste man hitta beredningsformer som levererar läkemedlet till upptagsstället utan att förstöras. Sådana projekt är inget vår grupp jobbar med i dagsläget.
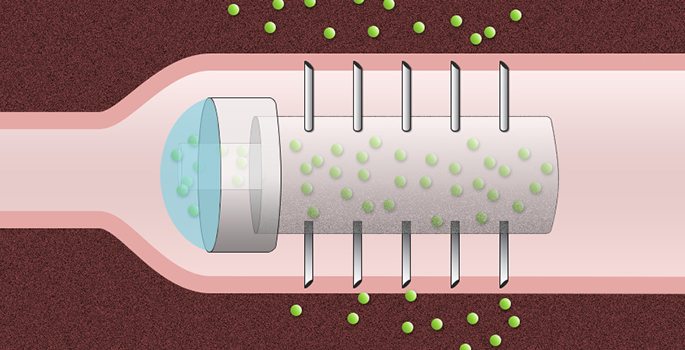
En idé som skulle kunna leda till att proteinläkemedel går att svälja publicerades i höstas. Forskare från MIT, däribland årets Scheelepristagare Robert S Langer, har kombinerat tabletter med injektioner. De gjorde en kapsel med nålar på sin yta som man ska svälja. Kapseln av akryl var två centimeter lång och gick att fylla med en aktiv substans. På ytan hade den fem millimeter långa nålar i rostfritt stål. Idén utgick ifrån att man sällan hittar några skador på tarmarna när människor av misstag råkar svälja vassa föremål. Att det dessutom inte finns några smärtreceptorer i tarmväggarna stödde teorin.
Man valde att använda insulin som testsubstans eftersom hormonet alltid bryts ner om det tas oralt, det påverkar alltså inte blodsockernivåerna. Däremot om insulinet i kapslarna nådde blodet gick det lätt att mäta effekten.
I försök på grisar gav insulinet i kapslarna en större verkan än vad subkutana injektioner gjorde. Effekten satte även in snabbare och kapseln levererade insulin redan i magsäcken och fortsatte att göra det hela vägen igenom tarmsystemet. Metoden verkade dessutom säker då det inte gick att se några skador från nålarna i tarmkanalen.
Störst nytta tror man att tekniken skulle kunna göra om kapseln laddas med större och mer komplexa molekyler än insulin. Sådana läkemedel är annars mycket svåra att göra i någon form där de kan absorberas i tarmarna och fortfarande ha kvar någon effekt. Exempel som forskarna nämner är biofarmaceutiska läkemedel som antikroppar som används mot cancer. Andra terapiområden är autoimmuna tillstånd, som artrit eller Crohns sjukdom. Metoden skulle också lämpa sig för till exempel vacciner som måste injiceras.
Studien är den första som visat att mikronålar kan användas för gastroenteral administration av biologiska läkemedel och troligt är att fler innovationer i jakten på proteinläkemedlen snart kommer se dagens ljus. Att kunna ge komplexa molekyler som kan sväljas öppnar upp stora möjlighet för en mer patientvänlig behandling. Och måste man ändå fortfarande injicera läkemedlen blir vardagen betydligt lättare med långtidsverkande effektiva terapier.