Efter att det i åratal varit mycket prat om läkemedel utskrivna i 3D-skrivare ser det nu ut att faktiskt bli verklighet i Sverige. Flera olika aktörer flaggar för att de kommer att börja använda 3D-skrivare för att producera läkemedel i klinisk praxis under nästa år.
Bland dessa är företaget Apotek produktion & laboratorier AB, APL. Tidigare i höstas gick APL ut med att de tänker börja producera läkemedel med hjälp av 3D-skrivare från finska Curifylabs under 2025. Det handlar om extemporeläkemedel, läkemedel som tillverkas på beställning, och som är individanpassade för en viss patient.
– Vi har ett samhällsuppdrag att tillverka extemporeläkemedel. Jag har sedan några år intresserat mig för vad som skulle vara möjligt att göra med en 3D-printer inom det samhällsuppdraget, säger Christina Holmberg på APL till Läkemedelsvärlden.
APL satsar på 3D-tekniken
Christina Holmberg är apotekare och farmacie doktor samt sektionschef för farmaceutisk utveckling på APL och som sådan ansvarig för införandet av 3D-tekniken på företaget. Hon berättar om en upplevelse som stärkte hennes intresse för den nya tekniken:
– Vid ett besök på Akademiska sjukhuset i Uppsala för två år sedan blev det tydligt att det behövs ytterligare utveckling av individanpassade läkemedel, när jag fick se hur en tablett krossas och en tredjedel av krosset slammas upp i vatten, för att ge det som en lägre, anpassad, dos till barn.
Nu har APL inlett ett samarbete med det finska företaget Curifylab som redan har levererat den första läkemedelsskrivaren som de har kunnat testa en tid. De kommer inte att tillverka traditionella, hårda tabletter utan istället mjuka tuggtabletter. Christina Holmberg berättar hur det går till:
– Man blandar den aktiva substansen med en bas, en blandning av olika hjälpämnen. Man fyller en patron med blandningen och sätter den i skrivaren som sedan klickar ut blandningen i blisterbubblor där den stelnar till mjuka tuggtabletter. Dessa kan man sedan tugga, svälja direkt, lösa upp i ett glas vatten eller ge via sond, säger hon.
Tekniken har många fördelar
De läkemedel som APL planerar att skriva ut är uteslutande generika eftersom det måste vara möjligt att köpa in den aktiva substansen. De aktiva substanserna förvaras torrt i pulverform och blandas med basen först när läkemedlet ska tillverkas.
Fördelarna med 3D-utskrivna läkemedel är flera. En given fördel är att det är möjligt att individualisera dosen. Små barn kan få låga doser som inte finns tillgängliga i kommersiella produkter och vuxna kan få specialdoser anpassade för dem.
Men det är också möjligt att tillverka läkemedel som har utgått eller är restnoterade, istället för att köpa in utländska läkemedel på licens. Med 3D-skrivare går det även att tillverka väldigt små mängder, till och med enstaka tabletter. Detta istället för de cirka 100 kapslar som är den minsta mängd som APL gör när man tillverkar kapslar för hand.
Start under nästa år
Men det finns även andra fördelar med 3D-utskrivna läkemedel som till viss del ligger bakom att APL beslutat att satsa på den nya tekniken.
– Det handlar också mycket om vår arbetsmiljö. Idag vid tillverkning av kapslar för hand, är risken stor att operatörerna får problem med förslitningsskador i handlederna. Den nya tekniken minimerar även dammande moment och ökar dosnoggrannheten, säger Christina Holmberg.
Hon berättar att APL planerar att starta produktionen av 3D-utskrivna läkemedel till patienter under tredje kvartalet 2025. Fram tills dess är det ett antal saker som måste lösas.
Först ska de riktiga produktionsmaskinerna levereras och installeras. Sedan måste man komma fram till rutinerna för att beställa dessa läkemedel.
Inga särskilda regler för 3D-läkemedel
En annan sak som måste ske innan fullskalig produktion kan dra igång är diskussionen med Läkemedelsverket. Christina Holmberg förväntar sig dock inga problem i den diskussionen utan att det kommer att handla om att visa att APL har kontroll på tillverkningsprocessen och att kvaliteten på produkten är bra.
Enligt Emil Schwan, chefsinspektör på Läkemedelsverket, finns det inget särskilt regelverk för 3D-utskrivna läkemedel.
– Nej, inte som specifikt nämner 3D-tekniken. Men det innebär inte att det är utan regler. Vi har arbetsgrupper som tittar på hur vi ska tackla dessa frågor när de väl kommer, säger han.
I grunden finns regelverket för god tillverkningssed, GMP, som reglerar all tillverkning av läkemedel.
– Det gör att det finns en vetenskaplig grund i hur man ska resonera kring detta. Det gäller ju alla läkemedel som tillverkas med någon form av ny metod. Det finns en ganska tydlig uppsättning kriterier som man ska uppfylla, säger Emil Schwan.
Flera aktörer är på gång
Och i motsats till fabrikstillverkade läkemedel som måste godkännas av Läkemedelsverket innan de kan börja säljas så behöver extemporeläkemedel till enskilda patienter inga sådana godkännanden.
– Nej, varje extemporeförskrivning är ett recept på hur läkemedlet ska tillverkas och vi godkänner inte varje förskrivning utan vi godkänner processen, hur väl den som tillverkar följer god tillverkningssed. Det finns en speciell föreskrift för tillverkning av extempore på apotek och då är det den man följer, säger Emil Schwan.
Att 3D-utskrivna läkemedel är något som verkligen är på gång är ställt utom allt tvivel. Förutom APL har även företaget Atrimus RX signalerat att de har för avsikt att starta extemporetillverkning av läkemedel med 3D-skrivare nästa år. Företaget är ett öppenvårdsapotek som ligger i ett industriområde norr om Stockholm och tanken är att sälja 3D-utskrivna läkemedel på distans till andra apotek.
Uppsala universitet på god väg
Även Uppsala universitet och Akademiska sjukhuset avancerar i sina planer på att starta tillverkning av 3D-utskrivna läkemedel direkt på klinikerna. Framför allt är det barn som behöver kunna få lägre och individanpassade doser.
– Vår ambition är att börja 3D-skriva läkemedel i klinisk praxis på Akademiska sjukhuset under nästa år. Vi har kommit långt i vår väg mot det målet, säger Christel Bergström, professor i molekylär galenisk farmaci vid Uppsala universitet, som länge varit drivande i införandet av 3D-tekniken i Sverige.
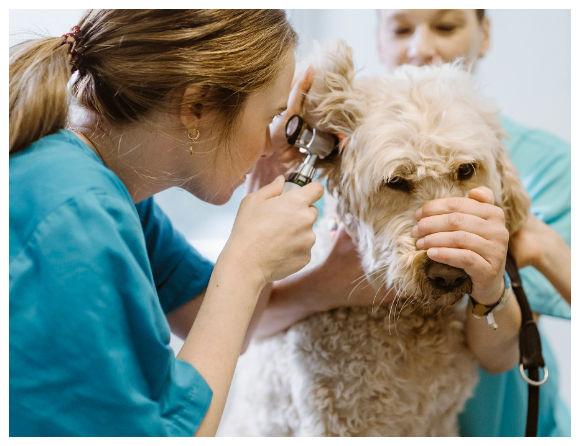
– För närvarande har vi skrivare uppsatta på Sveriges lantbruksuniversitet, SLU, här i Uppsala där vi nu kör en klinisk studie på hund. Så arbetet fortskrider enligt plan mot en tydlig klinisk användning och nytta för patienter.
Ser många nya möjligheter
Nu när det, som för bara några år sedan lät som science fiction, håller på att bli verklighet är det omöjligt att inte tillåta sig spekulera lite i vad som kommer härnäst. Hur kan 3D-utskrivna läkemedel utvecklas framåt? Christina Holmberg på APL igen:
– Jag tror att detta bara är början på denna teknik. När den utvecklas och vi får mer avancerade 3D-skrivare så tror jag att vi kommer kunna lägga flera substanser i olika lager i samma tablett. Så istället för att behöva svälja ett stort antal tabletter, så kan man ta en tablett som innehåller alla de aktiva substanser som man behöver.
– Eller så kan man göra tabletter med flera lager som har olika frisättningshastighet, till exempel ett lager med en snabblöslig smärtlindrare och ett lager som ger en långsammare frisättning av samma eller någon annan smärtlindrare. På så sätt får man både akut- och långtidsbehandling i en och samma tablett, säger hon.
Lika självklar som kaffebryggaren i framtiden?
Tittar hon ännu längre fram skymtar visioner om en verkligt individualiserad behandling.
– Jag skulle inte bli förvånad om det, i en framtid inte alltför långt bort, kan bli så att man lägger handen på mobilen som läser av blodtryck och puls och kanske några andra biomarkörer och sedan skickar en signal till en 3D-skrivare i hemmet som skriver ut en tablett med det man behöver just den dagen, säger hon.
Blir Christina Holmbergs vision verklighet? Kommer läkemedelsskrivaren vara lika självklar som kaffebryggaren i våra framtida hem? Vem vet, endast framtiden kan svara på det. Men onekligen låter det intressant.