Allt fler barn och ungdomar behandlas med de nya obesitasläkemedlen. De nya GLP-1-analogerna semaglutid och liraglutid mot obesitas, fetma, rekordökar. Det visar statistik från Socialstyrelsen som Läkemedelsvärlden var först med att redovisa.
Förra året, 2023, behandlades 847 patienter i åldrarna 0-19 år med någon av medicinerna. Antalet unga patienter har ökat med 2000 procent, alltså 20 gånger, på fem år. 2024 verkar bli ännu ett rekordår.
Men det räcker inte, tycker obesitasforskaren Ylva Trolle Lagerros, som helt nyligen blev Sveriges första professor i prevention vid Karolinska institutet. Hon är också kliniskt verksam som överläkare vid Centrum för obesitas i Region Stockholm.
– Det är toppen på isberget, bara en bråkdel av alla som skulle behöva behandlas. Vi räknar med att cirka 80 000 barn har obesitas, säger hon.
Barn och unga ska få vård tidigt…
Socialstyrelsens nya nationella riktlinjer för behandling av obesitas, som kom förra året, poängterar hur viktigt det är att barn och unga med obesitas får behandling så tidigt som möjligt.
Insatser i tidig ålder är viktiga för att hejda fortsatt viktuppgång. På så sätt minskar de också risken för fysiska och psykiska hälsoproblem i tidig vuxen ålder.
…men de flesta får ingen hjälp alls
Men enligt Ylva Trolle Lagerros, som satt med i den rådgivande expertgruppen för Socialstyrelsens riktlinjer, är de ungas verklighet oftast mycket långt ifrån riktlinjerna.
– Den stora majoriteten av barn och ungdomar med obesitas får ingen hjälp. Noll! De får varken stöd med levnadsvaneförändringar eller behandling med läkemedel, säger hon och fortsätter:
– Det fåtal som behandlas med de nya läkemedlen tillhör ofta geografiska upptagningsenheter där det finns specialenheter för unga med obesitas. Unga utanför de områdena får ofta ingen hjälp alls.
– Norröver i landet exempelvis, finns i princip inga specialistmottagningar alls för barnobesitas. Och det är inte så att färre unga lider av obesitas där, tvärtom.
Extra vaksamhet på obesitasläkemedlen
De nya läkemedlen är godkända för att behandla obesitas hos barn från tolv års ålder. Enligt godkännandet är läkemedlen ett komplement till minskat energiintag och ökad fysisk aktivitet.
Men eftersom obesitasläkemedlen är så nya finns en extra vaksamhet vad gäller oönskade effekter och risker. Medicinerna är därför föremål för utökad övervakning.
Maria State, chef för Socialstyrelsens analysenhet, pekar tidigare i en intervju med Läkemedelsvärlden, på osäkerheten när det gäller biverkningar på både kort och lång sikt. Och det gäller särskilt för barn och unga.
Kunskapen om effekt och säkerhet är ännu mer begränsad när det gäller unga än för vuxna. Det är mindre studerat hur dessa läkemedel påverkar barn och unga med obesitas än vuxna patienter.
Kan behöva ta obesitasläkemedlen livet ut
En annan fråga är om man måste ta de nya obesitasläkemedlen livet ut. Det skulle förstås särskilt kunna påverka barn och ungdomar, som i så fall behöver ta dem i många decennier.
Studier av Wegovy (semaglutid) mot obesitas visar att en betydande andel går tillbaka till sin ursprungsvikt när de avslutar behandlingen. En studie, publicerad 2022 i den vetenskapliga tidskriften Diabetes, obesity and metabolism visar att två tredjedelar av patienterna är tillbaka på sin ursprungsvikt ett år efter avslutad behandling.
Obesitasläkemedlen kan trappas ut
En mindre, ännu inte publicerad studie som presenterades på en obesitaskonferens i Venedig i maj, visar att var fjärde försöksperson behåller sin lägre vikt åtminstone sex månader om läkemedlet trappas ut. Det rapporterar exempelvis ABC News och Bloomberg news.
– Jag tror att det här kan komma att variera. Gissningsvis kommer en tredjedel kanske att kunna sluta med medicinerna och behålla vikten, en tredjedel kan behöva hjälp igen och en tredjedel kan behöva medicin resten av livet.
Stående ovationer av obesitasläkare
Ylva Trolle Lagerros poängterar istället den kunskap om läkemedlens effekt hos barn och unga med obesitas som faktiskt finns idag.
Hon nämner exempelvis studien av semaglutid i åldersgruppen 12-18 år som publicerades i slutet av 2022 i The New England journal of medicine, som Läkemedelsvärlden rapporterat om.
Studiens resultat, som du kan läsa mer om i faktarutan nedan, visar att tonåringar får en liknande positiv effekt som vuxna.
– Det släpptes fina resultat för tonåringar. Obesitasläkare från hela världen satt och lyssnade på presentationen av studien, säger hon och tillägger:
– För oss var det som en rockkonsert. Det blev stående ovationer eftersom vi alla vet hur svårt det är att behandla barn och unga med obesitas.
Obesitasläkemedlen ska ges även till unga
De nya obesitasläkemedlen behöver ingå i läkarnas verktygslåda för att behandla barn och unga med obesitas, tycker professorn.
– Forskningen visar att när det gäller barn så ska man ge allt som går att ge. Det finns ingen ”wait and see”, det måste tas på allvar och de måste få hjälp snabbt, säger hon och fortsätter:
– Ju mer man gör och ju tidigare man gör det desto bättre är det. Det ger större chans att vända vikttrenden.
Påverkar de ungas hela liv
Obehandlad obesitas kan påverka barnens framtid i oerhört hög grad, poängterar Ylva Trolle Lagerros.
Både svenska och utländska studier visar att dessa barn och unga presterar sämre i skolan. En svensk studie, publicerad i British medical journal open år 2021, visar exempelvis att barn med obesitas oftare går ut gymnasiet med ofullständiga betyg, jämfört med normalviktiga ungdomar.
– Enligt forskningen beror det inte på socioekonomiska skillnader, utan här verkar det vara just vikten som gör det knepigt, konstaterar hon.
– Många av de här barnen och ungdomarna utsätts också för mobbing på grund av sin obesitas och mår psykiskt dåligt. Att inte få fullständiga betyg innebär i förlängningen att det kan vara svårt för dem att få jobb och kunna flytta hemifrån, och därmed kanske också att hitta en partner och bilda familj.
De sjukaste ska prioriteras
Hälso- och sjukvården ska i första hand ges till dem är sjukast och i störst nöd, understryker professorn. Enligt Hälso- och sjukvårdslagen ska den som har störst behov av hälso- och sjukvård ska ges företräde till vården. Därmed borde barn och ungdomar med obesitas vara prioriterade, anser hon.
– Obesitas, inte minst i tidig ålder, är förknippad med en lång rad sjukdomar som högt blodtryck och andra hjärtkärlsjukdomar, diabetes typ 2, infertilitet, sömnapné, fettlever och så vidare. Då tycker jag att vi ska följa principen om att hälso- och sjukvården ska ges till dem som mest behöver den.
Svårare att arbeta med unga
Det är ofta helt annan sak att arbeta med barn och ungdomar som är överviktiga eller har obesitas än med vuxna, understryker hon.
Svårigheterna är annorlunda och på vissa sätt större.
– Det är mycket som händer i tonåren, dessutom är det inte helt ovanligt med neuropsykiatriska diagnoser som komplicerar.
Fetma är fortfarande stigmatiserat, vilket förstås även drabbar barn och unga.
– Det finns en inställning om att det räcker att ”skärpa upp sig” och sluta äta så mycket, att det handlar om dålig karaktär.
Ett brus av ”food noise”
Att obesitas handlar om bristande karaktär är en seglivad myt, enligt Ylva Trolle Lagerros.
– I grund och botten handlar det mycket om genetik, att man har ett ärftligt påbrå för att lägga på sig vikt.
Hon kallar det för ”food noise”, att hjärnan hela tiden signalerar att du är hungrig och behöver äta mer.
– Det är starka faktorer som driver ätande. När hungern slår till är den svår att hantera för vissa personer. Då hjälper de här läkemedlen till att begränsa aptiten.
Läkemedel bättre än inget alls
Läkemedelsbehandling ska kombineras med anpassade råd och stöd för att ändra kosten och öka den fysiska aktiviteten för att inte återgå till samma levnadsvanor som ledde till den höga vikten.
Men dagens vårdresurser för obesitasbehandling är begränsade, både inom specialistvården och primärvården, understryker hon.
– Naturligtvis är kombinationen av läkemedel och levnadsvanestöd det allra bästa. Men finns inte dietistresurs så kanske man får resonera som i USA, då får det blir läkemedel utan dietist.
Då måste också de nya obesitasläkemedlen kunna förskrivas i primärvården.
– Det är att jämföra med att läkare på vårdcentral förskriver antidepressiva läkemedel fast de inte kan erbjuda patienten terapi. Det är inte lika bra men det i alla fall något.
Höga priser ökar ojämlikheten ännu mer
Ylva Trolle Lagerros är besviken över att Tandvårds- och läkemedelsförmånsverket, TLV, bestämt att de nya obesitasläkemedlen inte ingår i läkemedelsförmånen.
– Jag trodde faktiskt att TLV skulle godkänna Saxenda för tonåringar. Idag är det är väldigt dyrt. Saxenda kostar omkring 2500 kronor per månad. Wegovy, som är ännu svårare att få tag på, kostar 3700 kronor i månaden.
Det höga priset gör att det är barn och unga till föräldrar som har råd att betala som får tillgång till läkemedelsbehandling.
– Det är problematiskt och gör vården mycket ojämlik, säger hon.
Hälsoekonomiskt lönsamt att behandla
De barn och ungdomar som obesitasläkare likt Ylva Trolle Lagerros behandlar med Saxenda har redan provat allt annat, förklarar hon.
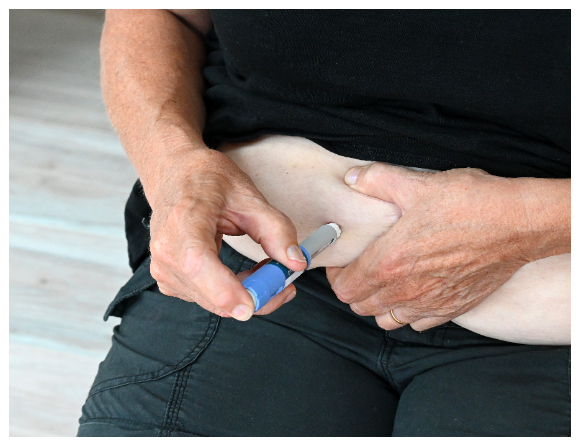
– Hur roligt är det att behöva ta en spruta varje dag? Det gör man inte för nöjes skull. Ingen förälder skulle utsätta sitt barn för det i onödan om det inte hade effekt.
– Det finns så väldigt mycket att vinna på att behandla barn och ungdomar tidigt. Och det är rimligen även hälsoekonomiskt lönsamt eftersom det kan påverka hela deras framtida liv.